北理工团队在光激活外泌体增敏肿瘤免疫治疗方面取得重要进展
发布日期:2022-09-17 供稿:前沿交叉科学研究院
编辑:朱倩云 审核:唐水源 阅读次数:
近日,国际顶级期刊Advanced Materials(影响因子32.086)报道了华体会hth·(体育)(中国)官方网站-华体会体育hth首页黄渊余课题组在光激活外泌体增敏肿瘤免疫治疗方面的研究进展,相关成果以“Photoactivatable Silencing Extracellular Vesicle (PASEV) Sensitizes Cancer Immunotherapy”为题发表。该工作第一作者为华体会hth·(体育)(中国)官方网站-华体会体育hth首页前沿交叉科学研究院/生命学院博士后陆梅博士、国家纳米科学中心邢昊楠博士,通讯作者为国家纳米科学中心梁兴杰研究员(北理工兼职教授)、北理工黄渊余教授,北理工为论文第一单位。
临床上患者对单一免疫疗法的总体响应率仅为10-30%。如何提高患者响应率是肿瘤免疫治疗领域有待攻克的重点。最近研究发现,P21活化激酶4(p21-activated kinase 4,PAK4)是肿瘤阻止杀伤性T细胞浸润,实现免疫逃逸的关键靶点。在低T细胞浸润患者的肿瘤组织中,PAK4表达丰富。此外,免疫原性弱也是导致肿瘤免疫治疗耐受的重要因素。胞外囊泡是新一代的药物递送载体,近年来广泛用于siRNA等核酸药物的递送,具低免疫原性、良好的循环稳定性及肿瘤趋向性。
基于此,梁兴杰研究员与黄渊余教授团队设计了新型的光激活胞外囊泡(PASEV),将免疫浸润与免疫激活进行有机组合,协同增敏肿瘤免疫治疗。首先,针对肿瘤阻止免疫细胞浸润、实现免疫逃逸的关键靶点PAK4,设计可特异沉默PAK4表达的siRNA(siPAK4),并将其与光可激活、活性氧(ROS)敏感的聚乙烯亚胺(PEI)进行组装,形成纳米复合物。然后,用M1型巨噬细胞的胞外囊泡对纳米复合物核心进行伪装,赋予其良好的生物相容性、良好的循环稳定性及肿瘤趋向性(图1)。
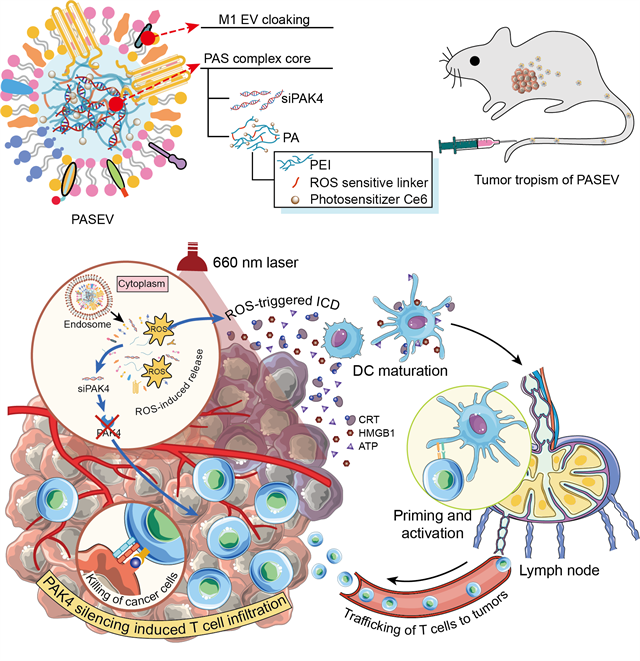
图1 PASEV的制备及抗肿瘤机制示意图
作者阐明了光激活胞外囊泡增敏肿瘤免疫治疗的机制,siPAK4可从源头上有效沉默肿瘤“守卫兵”PAK4的表达,阻断WNT/β-catenin信号通路,增加肿瘤组织中趋化因子CCL4等的表达水平,从而将细胞毒性T淋巴细胞招募到肿瘤内部,浸润肿瘤组织;光激活聚合物材料则可通过免疫原性细胞死亡级联反应(ICD)增强肿瘤免疫原性,促进树突细胞成熟,激活细胞毒性CD8+ T细胞(图2)。该研究为提高当前肿瘤免疫治疗的响应率,实现免疫增敏提供了新思路。
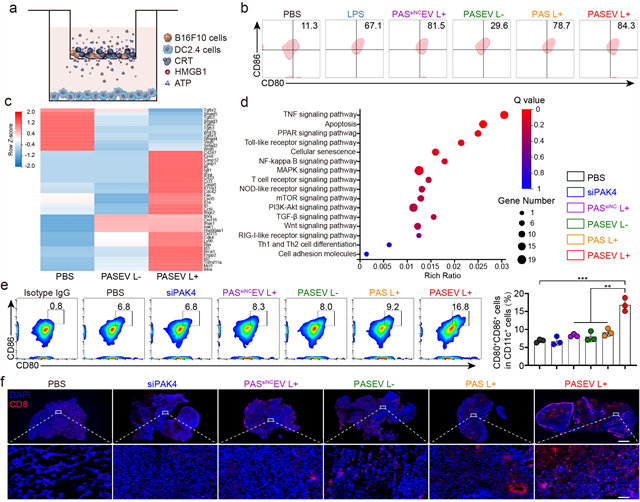
图2 PASEV增敏肿瘤免疫治疗的机制
论文链接: https://doi.org/10.1002/adma.202204765
分享到:
